Propiedades periódicas
Son propiedades que se van modificando al desplazarse por la tabla periódica en períodos y en grupos. Podemos mencionar: Radio atómico, energía de ionización y afinidad electrónica.Carga nuclear efectiva (CNE)
Es la carga detectada por un electrón teniendo en cuenta la carga del núcleo (número Z) y el efecto de apantallamiento de los demás electrones. Si en un átomo hay un solo electrón, la carga nuclear efectiva es igual a la carga del núcleo. Si hay varios electrones, apantallan la carga por lo que la carga nuclear efectiva es menor.Radio atómico
Es la distancia entre el núcleo y el último nivel de electrones.Aumenta al aumentar el período ya que se agregan más niveles de energía.
Disminuye al aumentar el grupo ya que al haber más protones aumenta la fuerza de atracción y por lo tanto los electrones están más cerca del núcleo.
Los cationes tienen un radio más pequeño porque tienen un electrón menos.
Los aniones tienen un radio más grande porque ganan electrones. Principalmente el radio es mayor al cambiar de nivel.
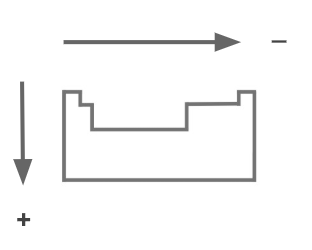
Energía de ionización (EI)
Es la energía mínima necesaria para remover un electrón de un átomo o ion gaseoso. Está relacionada al radio atómico ya que cuanto más chico es el átomo más energía se requiere para quitarle un electrón.Por ejemplo, el litio (Li) tiene tres electrones en su estado original, dos en el primer nivel y uno en el segundo. Si queremos Li +, la energía requerida es baja. Con los metales de más a la izquierda de la tabla periódica ocurre lo mismo.
En cambio el flúor tiene 7 electrones en el último nivel. Es muy difícil quitarle un electrón ya que solo le falta uno para completar ese nivel de energía. Al aumentar el grupo aumenta la energía de ionización. Al aumentar el período disminuye la energía de ionización.
La energía de ionización representa que tan fuerte está unido un electrón a un átomo.
La primera energía de ionización es la energía para quitar un primer electrón, la segunda energía de ionización es la energía para quitar un segundo electrón, etc. Siempre la primera es menor que la segunda, la segunda es menor que la tercera y así sucesivamente.
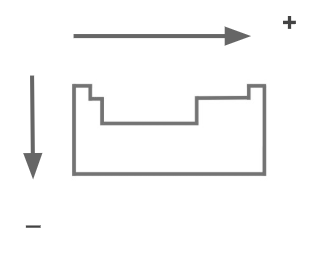
Afinidad electrónica (AE)
Es el cambio de energía de un átomo al agregar un electrón. Por ejemplo en el caso del flúor es muy fácil formar F -, entonces la AE es muy alta. En el litio la AF es baja. Al igual que la energía de ionización, aumenta con el grupo y disminuye con el período.
Electronegatividad
Es la fuerza que tiene un átomo para atraer electrones.Se utiliza de forma comparativa entre dos átomos. Los electrones van desde el átomo con electronegatividad menor hacia el átomo con electronegatividad mayor.
Cl -> 3,2
Li -> 1
Entonces los electrones van desde el litio al cloro.
Cuando la diferencia en la electronegatividad es baja el electrón se comparte formando un enlace covalente. Cuando la diferencia es alta el electrón pasa al otro átomo, formando un enlace iónico.
Electrones de valencia
Son los electrones que se encuentran en el nivel de energía principal más alto que posee el átomo.Seguir a metales y no metales
Volver a introducción a la química
Volver a home