
Estructura de la materia
¿Cuál es la unidad fundamental de la materia?
La materia que conocemos está formada por unidades fundamentales llamadas átomos. Un átomo es la porción más pequeña de materia que posee identidad. Los átomos tienen un núcleo compuesto por protones y por neutrones. Alrededor del núcleo se encuentran otras partículas llamadas electrones. A las partículas que forman el núcleo (protones y neutrones) algunos autores las denominan nucleones.
La cantidad de protones de un átomo se denomina número atómico y se representa por la letra Z. Este número determina la identidad y las propiedades específicas de cada elemento. Sabiendo la cantidad de protones que un elemento químico tiene sabemos de qué elemento se trata. Por ejemplo el hidrógeno está compuesto por átomos que poseen un solo protón en su núcleo, el helio por átomos que poseen dos protones, etc.
Existe una gran cantidad de elementos químicos conocidos. Los elementos químicos tienen un nombre y se representan por una letra mayúscula sola o por una letra mayúscula seguida de una o dos letras minúsculas.
Por ejemplo el hidrógeno se simboliza con H, mientras que el helio se simboliza con He.

Moléculas
La mayoría de los elementos químicos no se encuentran solos en la naturaleza sino junto a otros formando moléculas. Estas moléculas pueden estar formadas por átomos de un mismo elemento químico o por átomos de diferentes elementos. Por ejemplo el ozono (O3) se forma por tres átomos de oxígeno mientras que el agua (H2O) está formada por dos átomos de hidrógeno y uno de oxígeno.
Carga eléctrica
La carga eléctrica es una propiedad de las partículas que forman el átomo. Los protones tienen carga positiva, los neutrones no tienen carga y los electrones tienen carga negativa.Las partículas de igual carga se repelen mientras que las partículas de carga diferente se atraen. En equilibrio electrostático, un átomo tiene la misma cantidad de electrones que de protones. Cuando un átomo cede o gana electrones tiene una carga diferente de cero. Si el átomo cede electrones tiene carga positiva mientras que si gana electrones tiene carga negativa.
Iones
Un átomo o una molécula con carga se denomina ión. Si la carga es positiva se denomina catión mientras que si la carga es negativa se llama anión.
Isótopos
Un mismo elemento químico tiene una determinada cantidad de protones pero pueden encontrarse átomos con diferente cantidad de neutrones. Las variedades de estos átomos según su cantidad de neutrones se denominan isótopos.Número atómico (Z)
Es la cantidad de protones que tiene el átomo de un determinado elemento. Este número es fijo para cada elemento.Número de neutrones (N)
Es la cantidad de neutrones que tiene un átomo. Recordemos que normalmente para un mismo elemento existen átomos con diferente cantidad de neutrones llamados isótopos.Número másico (A)
La masa de los átomos es una cantidad muy pequeña. Se mide en unidades llamadas UMA (unidad de masa atómica). Los protones y los neutrones tienen la misma masa, equivalente a 1 UMA. Los electrones tienen una masa mucho menor y por lo tanto no se considera su valor al calcular la masa del átomo.Por lo tanto, como los protones y los neutrones tienen masa equivalente a 1 UMA, si queremos calcular la masa del átomo simplemente sumamos la cantidad de protones y de neutrones. Esa suma se denomina número másico y se indica con la letra A.
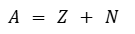
También podemos decir que el número de neutrones es igual al número másico menos el número atómico.
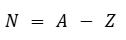
Representación de isótopos
Para representar un isótopo se indica normalmente al símbolo del elemento (X) junto con el número másico (A) y el número atómico (Z).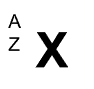
Masa atómica promedio
Es el valor de masa atómica para cada elemento ponderando su abundancia en la naturaleza. Este valor es el que normalmente encontramos en la tabla periódica.Carga (C)
Indica la carga del átomo y es un número entero.En equilibrio electrostático un átomo tiene carga cero ya que posee tantos electrones como su número de protones. Si en cambio hay menos electrones entonces el átomo tiene carga positiva (ya que los electrones son negativos). De la misma manera, si el átomo gana electrones su carga es negativa.
Constante de Avogadro
Es un número equivalente a 6,02 x 1023 y se denomina Mol.Es importante mencionar que el número de Avogadro no tiene unidades ya que es simplemente una cantidad, tal como si dijéramos docena. Por lo tanto podríamos tener un mol de átomos, un mol de moléculas, etc.
Masa molar (M)
Es la masa que tiene un mol de una determinada sustancia. Se mide en g/mol.Para elementos químicos, la masa molar en gramos tiene el mismo valor numérico que la masa atómica en UMA. Por ejemplo, un átomo de carbono tiene una masa atómica de 12 UMA y la masa molar del carbono es de 12 g/mol.
Resumen
| Carga | Masa | ¿Qué define? | |
|---|---|---|---|
| Electrón | Negativa | No se considera | Ión |
| Protón | Positiva | 1 UMA | Elemento |
| Neutrón | Sin carga | 1 UMA | Isótopo |
Seguir a configuración electrónica
Volver a introducción a la química
Volver a home