
Concentración de soluciones
La concentración es la proporción de soluto en relación a la solución. En algunos casos también se calcula como la proporción de soluto en relación al solvente.
Es importante tener en cuenta que, en una solución dada, la concentración es una propiedad intensiva, es decir que no varía con la cantidad de solución. En cambio, las cantidades individuales de soluto, solvente o solución sí son propiedades extensivas.
Existen varias formas de expresar la concentración en una solución. A continuación detallaremos las más utilizadas.
Porcentaje masa en masa (% m/m)
Expresa el porcentaje de masa de soluto en el total de masa de la solución. Es equivalente a los gramos de soluto por 100 g de solución.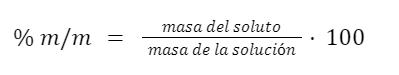
Porcentaje masa en volumen (% m/v)
Expresa el porcentaje de masa de soluto por unidad de volumen de solución. Es equivalente a los gramos de soluto por 100 ml de solución.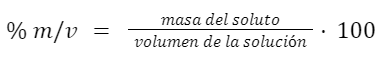
Porcentaje volumen en volumen (% v/v)
Expresa el porcentaje de volumen de soluto en el volumen de la solución. Es equivalente a los mililitros de soluto por 100 mililitros de solución.
Molaridad (M)
Expresa la cantidad de soluto por unidad de volumen de solución. Normalmente se utiliza el número de moles por litro.
Molalidad (m)
Expresa la cantidad de soluto por unidad de masa de solvente. Normalmente se utiliza el número de moles / kilogramo. Debemos tener en cuenta que, a diferencia de otras medidas de concentración, en el denominador estamos haciendo referencia al solvente y no a la solución.
Fracción molar (X)
Expresa la cantidad de sustancia de soluto sobre la cantidad de sustancia de la solución, normalmente medidas ambas en moles.
Seguir a diluciones
Volver a soluciones
Volver a home